神経膠腫(グリオーマ)
神経膠腫(グリオーマ)について 神経膠腫(グリオーマ)は、髄膜腫に次ぐ頻度の高い腫瘍で、神経細胞の働きを補助するグリア細胞から発生する腫瘍です。分類すると多くの種類がありますが、病理組織学的所見に基づき悪性度が良好なものから悪性度の高いものまでにわたりグレード1からグレード4まで分類されます(最近では、臨床経過・予後予測因子をふまえ、病理組織所見に遺伝子診断を加味して、総合的に診断するよう規約が改められました)。病理学的所見によって治療方針・生命予後が異なりますので、正確な診断を得るために手術は必須になります。手術の原則は「最大限の摘出に、最小限の後遺症・神経機能温存」です。しかし、大部分の腫瘍は脳の中に浸潤するように発育するため、また正常脳とグリオーマ病変の境界が不明瞭であり、手術で全摘することが極めて困難です。
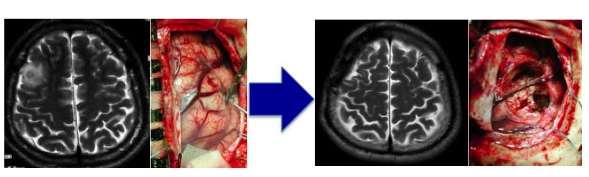
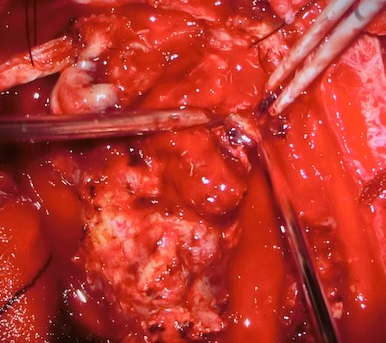
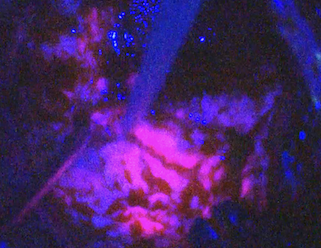
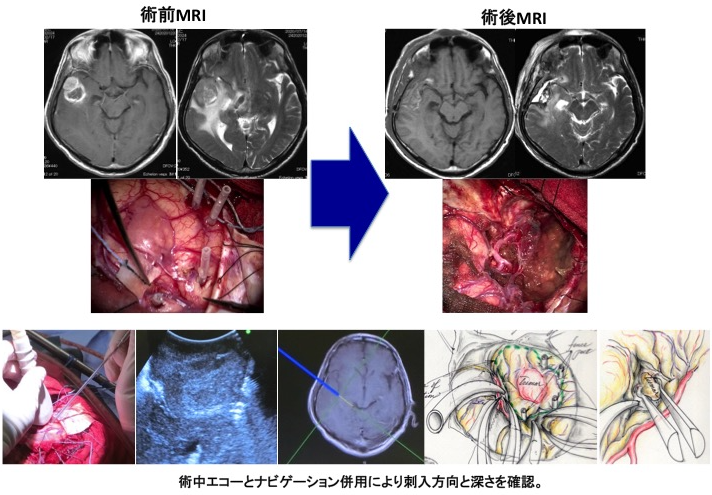
(術前MRIと摘出前の術中所見) (術後MRIと摘出後の術中所見) グレード1は外科手術のみで完治が期待でき生命予後が良いのですが、グレード2以上では多くの場合、手術のみでは治療として不十分であり、術後放射線治療や化学療法が必要となります。つまり、放射線治療専門医やがん化学療法に精通している医師のいる施設で治療を受けるべきです。 当院は、脳腫瘍病理診断・脳腫瘍手術・放射線治療・がん治療専門医が常駐しており、当院での治療を通じて日本の脳腫瘍に対する先端医療の提供しております。また再発をきたし、ターミナルステージになった際には、医療支援センターが在宅療養・ホルピス転院など患者のみならず家族への支援ができる体制も整備しております。当院では、初診から最期まで地元密着型で対処し、地域医療に貢献することをモットーとしています。 (当院ホームページ脳腫瘍専門外来や当院がん診療科医師の紹介もご参照ください) 神経膠腫(グリオーマ)の治療方針 当院での神経膠腫(グリオーマ)治療の原則は、情報誘導手術による最大限の脳腫瘍摘出と標準的な放射線化学療法です。これは、できるだけ腫瘍細胞の数を腫瘍摘出することで減らし、病理学的所見や腫瘍の遺伝子解析の結果を基に総合的に診断をして、世界で認められている標準的な放射線・化学療法を行います。当院でできない遺伝子検査(オンコパネルなど)については、他の大学や医療機関に解析を依頼しております。 手術には光線力学的診断剤のアラベル(アミノレブリン酸塩酸;5-ALA)を併用します。5-ALAから生合成されるプロトポルフィリンIXが選択的に腫瘍細胞に蓄積し、これに励起光を照射すると赤色蛍光が発せられることから腫瘍が明瞭に見えます。これに電気生理学的モニタリングを併用し、手術操作による神経機能の温存を目標とし、細部にわたり腫瘍を取り除くよう努めております。 (術中所見) 如何に腫瘍を残さず摘出するかが治療成績を左右する疾患であります。このため本腫瘍に対する摘出術において術中MRIを併用することが有用であることはすでに報告されています。当科では術中MRI手術室を有しています。術中MRI手術室を保有している施設は近年増えておりますが、当院は全国で7番目に(2007年12月から)運用を開始しておりました。現在は諸事情により休止中です。 上段;術中所見 (左;摘出前、中;マーカー(シリコン製チューブ)挿入、右;摘出後) 下段;術中所見に準じた頭部MRI所見) http://www.hoajonline.com/journals/pdf/2052-6946-1-6.pdf 従来の手術は、外科医の経験と技術に大きく依存しておりました。“最大限の摘出率でかつ最小限の後遺症”を目指した脳腫瘍手術を遂行するために、術中画像支援装置や電気生理学的モニタリングと術中迅速病理診断を駆使し、我々は手術の精度を上げ、若手術者を育成することに尽力してきました。 腫瘍の位置情報(解剖学的情報)、どこに重要な脳の働きをする場所があるかの情報(機能的情報)、摘出したものが腫瘍であるかどうかの情報(組織学的情報)を参考に、腫瘍を最大限に摘出することが可能になりました。一見すると判別しにくい腫瘍と正常脳の境界を迷うことなく同定するには、術中ナビゲーションは不可欠です。
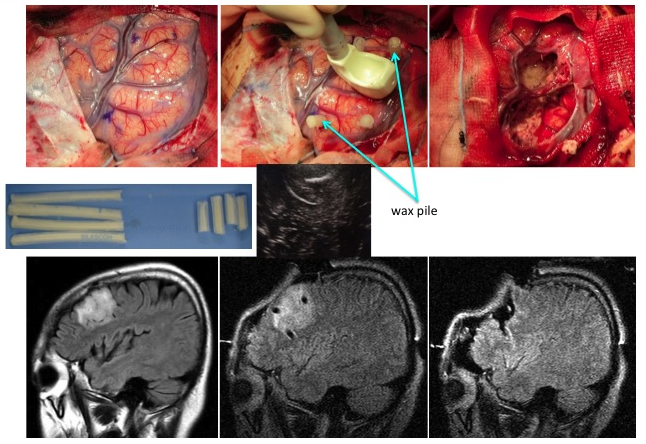
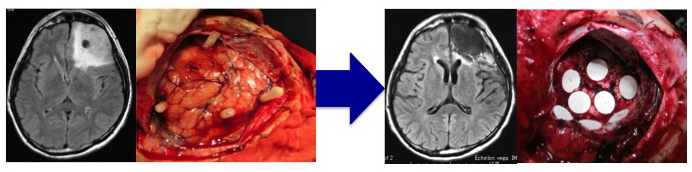
また、言語や運動機能に関与している領域に近いところに存在している腫瘍を摘出する際には、運動誘発電位を施行し、術後に半身不随(麻痺)を防ぐべく摘出操作を進めております。正常組織とグリオーマ組織の境界は肉眼的に不明瞭であるため、術者の見極めが困難であるため、どこまで摘出すべきかを確認するためには、腫瘍境界部の組織を摘出し、前述した5-ALAによる光線力学的診断と手術中に迅速病理診断を併せて行っております。これらは、次世代を担う若手術者の育成ツールとしても極めて有用です。 またカルムスチンを生体内分解性ポリマー基剤に含めた脳内留置用徐放製剤であるギリアデルが、2013年から日本でも保険適応となりました。本剤は注射薬に比べて高濃度で脳腫瘍細胞に暴露できること、重篤な副作用が減らせること、術後の直接患部に留置できることにより脳血液関門による薬剤投与の非効率性を克服することが期待できることが特徴です。手術後の標準治療を開始するまでの治療空白期間に治療が可能なこともメリットとしてあげられます。当科でも適応症例を選んで腫瘍摘出腔に留置しております。
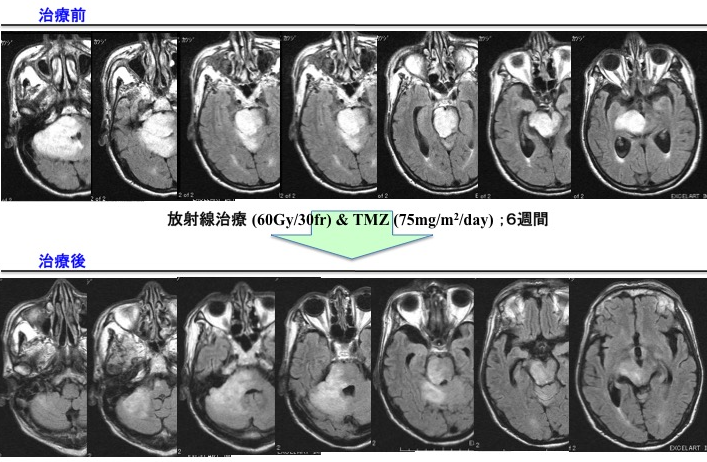
(術前MRIと腫瘍摘出前) (術後MRIとギリアデル留置した腫瘍摘出後) 前述の如く、神経膠腫(グリオーマ)は、一部の腫瘍を除き手術のみで完治させることはできません。従って、術後に放射線治療と化学療法は不可欠です。手術後にどのような補助療法を行なうかは施設により意見が分かれるところです。しかし最近では欧米を中心に、複数の施設による大規模で多数の患者に対して信頼性の高い試験が行われております。我々はそれらの最新結果を基にして十分な説明を行い、納得・同意を得た上で補助療法を決定しております。放射線治療を主軸に化学療法を併用する標準治療が原則ですが、特に化学療法剤であるテモゾロマイド (TMZ)は経口投与の可能な薬剤であり、副作用が少なく簡便に治療ができます。当科でも従来の化学療法を凌駕する治療成績の向上がみられています。 (脳幹グリオーマに対し生検術施行後、放射線とTMZが著効した1例) 現在の補助療法を下記に挙げますが、これらは一般治療方針であり、患者さん毎に異なる場合や新たな試験結果で変更する場合があることをご了解ください。また医学の発展のために、充分な説明を行ったうえで、臨床研究への参加へのご同意・ご協力をお願いする場合があります。 [初期治療] Grade 2:手術±放射線治療±化学療法(TMZ;テモゾロミド、またはPMV)
→原則、補助治療せず画像検査による経過観察とします。 (2)上記条件にはずれる場合は、補助治療を行います。
→乏突起膠腫(オリゴデンドログリオーマ)と診断 PCZ(プロカルバジン)+MCNU(サイメリン)+VCR(ビンクリスチン)(PMV)併用療法またはTMZ。放射線治療せずに化学療法単独治療を行います。
→星細胞腫(アストロサイトーマ)と診断 TMZが第一選択。場合によってはMCNU(サイメリン)+VCR(ビンクリスチン)。 増殖能力が5% 以上の場合は放射線治療を上乗せします。 ※ grade 2に対する術後放射線治療の時期については、最初から積極的に照射する方法(early radiation)と再発しgrade3または4に悪性転化してから照射する方法 (late radiation)があります。文献的にはearly radiationの方が無病増悪期間を延長するが、生命予後には双方で有意な差がない、というのが一般的なコンセンサスです。どちらを選択するかは個々の状況によって総合的に判断して決めているのが現状です。 Grade 3 :手術+放射線治療+化学療法 放射線治療に化学療法を併用します。 化学療法の内容は、組織診断によって使い分けを考慮しますが、原則TMZが第1選択。
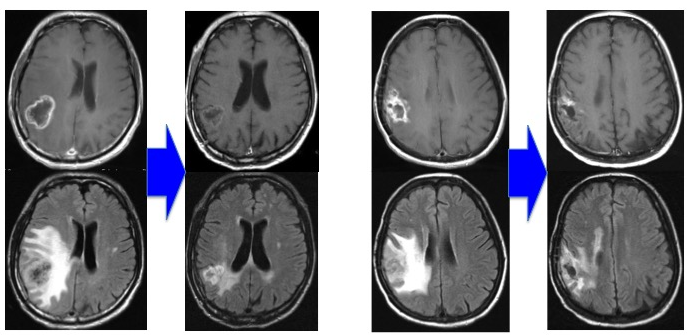
※ 乏突起膠腫では、全摘できた場合は放射線治療を回避する場合があります。 Grade 4(膠芽腫):手術+放射線治療+化学療法(TMZ±Bev(アバスチン))±交流電場腫瘍治療(NovoTTF) 放射線治療に化学療法を併用します。(治療期間は6週間ですが、高齢者の場合は放射線治療を3週間に短縮して行うこともあります。その場合でもTMZは6週間使用します。) ※1. 尚、Grade 3およびGrade 4に対しては、2013年7月からBev (アバスチン)を併用治療が保険診療の適応となりました。原則2週間毎の点滴加療となります。当院には外来化学療法室が整備され、専属の看護師が常駐しており、通院治療が可能です。Bevの使用法については、議論のあるところですが、当科では初発例から積極的に使用しています。特に生検・部分摘出例、高齢者、再発症例、QOL(生活の質)不良症例では、全身状態を考慮しつつ使用し、治療効果を認めています。 (2014年10月 第73回日本脳神経外科学会総会など、で発表) (治療前) 治療後) (治療前) (治療後) ※2.当科では本院との協同研究により2004年から樹状細胞・腫瘍細胞融合ワクチンの臨床治験を施行しています。 http://www.neurosurgery.jp/braintumor/index.html#04d2 http://www.jikei.ac.jp/academic/course/17_akuseisyuyo.html Grade 2からGrade 4までで、自立した生活が可能な患者さんが対象となります。但し樹状細胞・腫瘍細胞融合ワクチン・化学療法とも治療の対象となる条件(年齢や腫瘍の型や状態)があり、治療のご希望に添えないことがあります。 まだ治験中の段階ですが、樹状細胞・腫瘍細胞融合ワクチンとTMZ・Bev治療の併用療法は世界中で当科でのみ行われている治療です。Bevは、腫瘍による免疫監査機構抑制効果に対して拮抗することが知られており、従来の免疫治療の効果をより高めると期待されています。 Med Oncol. 2019 Nov 11;37(1):2. doi: 10.1007/s12032-019-1329-2.
希望に応じて対処しております。 臨床研究 当科では、以下の研究課題に関して東京慈恵会医科大学倫理委員会より承認された臨床研究を行っています。
研究への参加は任意です。参加しない場合でも不利益を被ることはありません。また研究実施・継続されることに関していつでも拒否できます。 提供を受けた血液等の試料・情報は、匿名化された後、研究代表者の下で保管され、研究に使用します。セキュリティ対策を万全に行います。この研究で得られたデータや解析結果は、登録番号の元で管理され、研究終了後も東京慈恵会医科大学附属柏病院・脳神経外科教室において厳重に保管されます。 診療情報や解析結果は登録番号のもとで管理され、患者さんの名前や住所などの個人を特定できる情報は使用されません。学会や医学論文などで研究結果が発表される場合はありますが、その場合も個人情報は守られます。また、研究が患者さんの権利や安全が守られて実施されていること、研究が研究実施計画書を遵守して実施されていることを確認するために、倫理審査委員会の委員や研究事務局の担当者や研究組織のモニタリング・監査担当者等が診療記録類を確認(閲覧)する場合がありますが、この場合も個人情報は守られます。 <個人情報保護相談窓口> 本研究に係る研究対象者の個人情報は第三者へ提供いたしません。 研究参加・不参加に関する連絡、研究対象者の個人情報の開示等の請求・苦情・問い合わせ先は、研究責任者(下記)の他、所属病院個人情報保護相談窓口(附属柏病院:04-7164-1111、内線2183)とします。 相談窓口 <連絡先> 〒277-8567 千葉県柏市柏下163-1 東京慈恵会医科大学附属柏病院脳神経外科 田中 俊英 TEL : 04-7164-1111(内線 3461) |